程序化死亡分子1(programmed cell death protein 1,PD-1)为I型跨膜糖蛋白,是免疫反应中重要的负性调控因子。在正常情况下,PD-1通过与其配体PD-L1,PD-L2结合抑制T淋巴细胞的功能,从而抑制自身免疫应答。
PD-1是免疫反应中重要的检查点分子之一,主要在外周组织中的成熟细胞毒性T淋巴细胞上和肿瘤微环境(TME)中表达。研究发现,PD-1的两个配体,PD-L1和PD-L2也由肿瘤细胞表达,从而导致免疫耐受。近年来,免疫检查点阻滞剂抗PD-1、抗PD-L1抗体已用于治疗多种人类肿瘤,如黑色素瘤、肾细胞癌、NSCLC、霍奇金淋巴瘤。但研究表明,尽管已广泛使用PD-L1作为有利的生物标志物,病人对抗PD-1/PD-L1药物的反应率仍然只达到20-40%左右。目前,免疫检查点治疗(ICT)针对PD-1/PD-L1的基本机制还未完全了解。最近的研究表明,PD-1在缺乏适应性免疫的癌症中起重要作用。但是,PD-1在肿瘤细胞上表达的潜在功能和机制仍然未知。
近日,中科院苏州医工所生物标志物研究中心在Publish form for Proceedings of the National Academy of Sciences发表研究论文“Tumor cell-intrinsic PD-1 receptor is a tumor suppressor and mediates resistance to PD-1 blockade therapy”(链接:https://www.pnas.org/content/117/12/6640),发现肿瘤细胞中同时表达PD-1和PD-L1,在缺乏适应性免疫的情况下,PD-1/PD-L1信号轴通过包括AKT和ERK1/2两大经典信号通路抑制肿瘤的生长。该研究突出了PD-1信号传导途径的分子功能和机制,揭示了肿瘤细胞固有的PD-1可作为患者选择ICT的潜在生物标记。
首先,研究者在13种不同的肿瘤细胞中,包括40种细胞系,检测了PD-1的核酸水平和蛋白水平,发现在这些肿瘤细胞中PD-1都有表达。同时,也检测了这些肿瘤细胞的PD-L1的蛋白表达水平。除此,在七个肺癌患者的肿瘤组织中,其中有两例患者也同样检测到了PD-1的表达(%≧2)。接着,为了研究PD-1和PD-L1在肿瘤细胞系的功能,研究者利用在细胞中敲减或过表达PD-1和PD-L1进行实验,发现PD-1和PD-L1都是肿瘤抑制性分子。同样地,小鼠皮下移植瘤实验也验证了与体外实验同样的结论。那么PD-1/PD-L1是如何影响了肿瘤细胞的增殖?研究者发现,在敲减或过表达PD-1和PD-L1的同时,会引起经典信号通路中AKT和ERK1/2蛋白磷酸化水平的变化。这说明肿瘤细胞中的PD-1和PD-L1是通过包括AKT和ERK1/2在内的经典信号通路影响肿瘤细胞的生长的。
随后,研究者继续探索了在肿瘤细胞中,PD-1和PD-L1也是通过相互作用发挥功能的。该研究通过一系列实验设计发现,在同一株细胞中同时过表达PD-1和PD-L1会进一步抑制肿瘤细胞的生长;而同时敲低两者后则不会进一步加剧肿瘤细胞的生长,这表明在肿瘤细胞中,PD-1同样是依赖于受体PD-L1发挥功能的。
 目前,PD-1抗体和PD-L1抗体越来越多的应用于对肿瘤病人的治疗。并且,有研究发现,肿瘤细胞中表达PD-1,利用抗PD-1抗体治疗后抑制了肿瘤细胞的生长,如黑色素瘤,肝癌等;在没有适应性免疫的情况下,以PD-1为靶点的抗体治疗会降低卵巢癌和膀胱癌细胞的细胞生长。这些数据都表明,肿瘤细胞固有的PD-1是潜在的癌基因。但是,也有功能研究表明,表达PD-1的鼠类肿瘤细胞在PD-1靶向抗体治疗下在体内和体外均显示出促进肿瘤生长,这表明肿瘤细胞固有的PD-1在NSCLC中起着抗肿瘤作用,这也为有些病人并不能对抗PD-1抗体的治疗有效应答提供了一定的证据支撑。因此,为了进一步研究PD-1在肿瘤细胞中的作用,研究者利用免疫缺陷小鼠构建了荷瘤鼠,然后分成三组,分别腹腔注射IgG可溶性蛋白,Nivolumab和Pembrolizumab,发现注射Nivolumab和Pembrolizumab的两组小鼠荷瘤明显比对照组长的快。一致的,免疫组化结果显示,注射Nivolumab和Pembrolizumab的两组小鼠荷瘤中的AKT和ERK的磷酸化水平明显升高。因此该研究进一步揭示了PD-1是一种肿瘤抑制因子,可抑制体内系统中的经典信号通路,例如AKT和ERK1/2通路。除此,研究者还发现PD-1阻断还会促进结肠癌细胞的生长和激活AKT和ERK1/2信号通路。这表明,PD-1的抗肿瘤功能不仅限于NSCLC,而且可能在多种肿瘤类型中起作用。这些研究表明,肿瘤细胞固有的PD-1在不同的肿瘤类型/细胞系中起拮抗作用。
目前,PD-1抗体和PD-L1抗体越来越多的应用于对肿瘤病人的治疗。并且,有研究发现,肿瘤细胞中表达PD-1,利用抗PD-1抗体治疗后抑制了肿瘤细胞的生长,如黑色素瘤,肝癌等;在没有适应性免疫的情况下,以PD-1为靶点的抗体治疗会降低卵巢癌和膀胱癌细胞的细胞生长。这些数据都表明,肿瘤细胞固有的PD-1是潜在的癌基因。但是,也有功能研究表明,表达PD-1的鼠类肿瘤细胞在PD-1靶向抗体治疗下在体内和体外均显示出促进肿瘤生长,这表明肿瘤细胞固有的PD-1在NSCLC中起着抗肿瘤作用,这也为有些病人并不能对抗PD-1抗体的治疗有效应答提供了一定的证据支撑。因此,为了进一步研究PD-1在肿瘤细胞中的作用,研究者利用免疫缺陷小鼠构建了荷瘤鼠,然后分成三组,分别腹腔注射IgG可溶性蛋白,Nivolumab和Pembrolizumab,发现注射Nivolumab和Pembrolizumab的两组小鼠荷瘤明显比对照组长的快。一致的,免疫组化结果显示,注射Nivolumab和Pembrolizumab的两组小鼠荷瘤中的AKT和ERK的磷酸化水平明显升高。因此该研究进一步揭示了PD-1是一种肿瘤抑制因子,可抑制体内系统中的经典信号通路,例如AKT和ERK1/2通路。除此,研究者还发现PD-1阻断还会促进结肠癌细胞的生长和激活AKT和ERK1/2信号通路。这表明,PD-1的抗肿瘤功能不仅限于NSCLC,而且可能在多种肿瘤类型中起作用。这些研究表明,肿瘤细胞固有的PD-1在不同的肿瘤类型/细胞系中起拮抗作用。
近年来,以CTLA-4、PD-1和PD-L1等为靶点的免疫检查点抑制剂也广泛地应用于临床。但是,在使用这些药物的同时,在临床上有些患者也出现了其他免疫相关的反应,如肿瘤病变或者肿瘤外观的初始增大,随着药物的继续使用,肿瘤负荷将会减轻。这种临床反应被称为假进展(pseudoprogressive disease,PPD)有些患者即在使用药物治疗后,患者的病情非但没有好转,肿瘤反而生长加快,病情恶化,这就是超进展(hyperprogressive disease,HPD)。但是,HPD的机制尚未明确。而该研究可能为PPD和HPD提供了解释。即当抗体有效激活T细胞时,肿瘤细胞被激活的T细胞破坏。但是,如果患者在刚开始使用抗体治疗后,活化的T细胞水平较低,不足以消灭肿瘤细胞,则肿瘤会通过激活肿瘤固有的PD-1/PD-L1功能而更快地生长,并在T细胞过度激活后发生退化,称为PPD。相比之下,某些病人本身免疫力低下,抗体激活的T细胞一直处于低水平状态,或肿瘤细胞上PD-1/PD-L1表达适当升高的情况下,抗体介导的治疗会增强肿瘤细胞的生长并增强抗肿瘤免疫力,从而导致HPD发生。总之,该研究为这一观点提供了进一步的数据支撑,即在进行PD-1/PD-L1阻断后,T细胞的活化与肿瘤细胞生长之间的平衡可能对于免疫检查点治疗的临床结果至关重要。
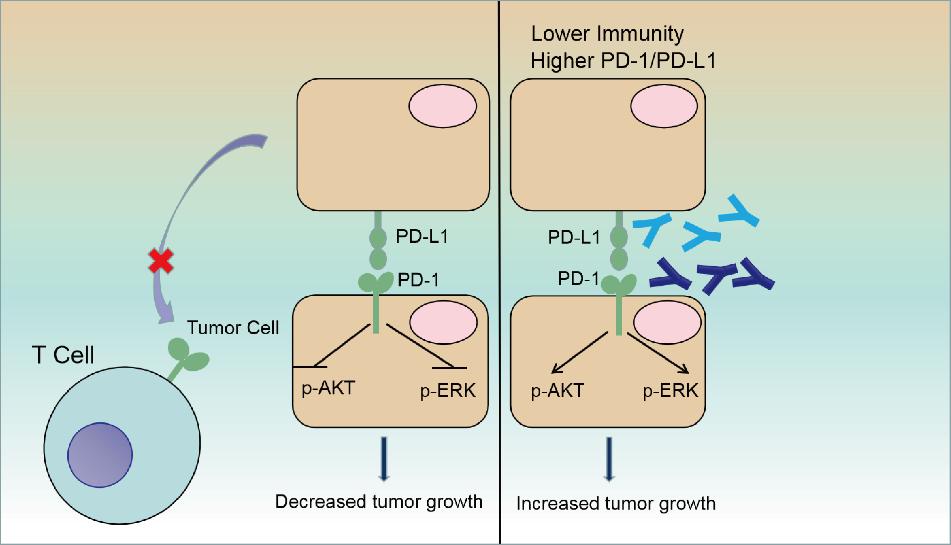
图1:肿瘤细胞表达PD-1/PD-L1,PD-1/PD-L1通过调节包括AKT和ERK1/2途径在内的经典信号通路来抑制肿瘤细胞的生长。
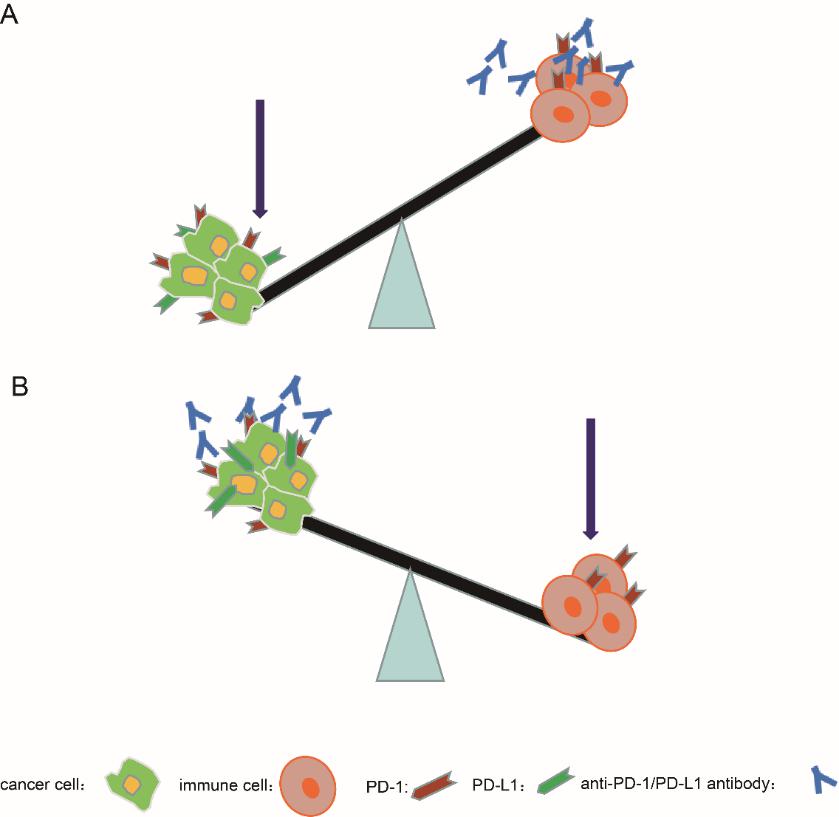
图2:(A)靶向PD-1/PD-L1的抗体有效激活T细胞,因此肿瘤细胞被识别并消灭。(B)靶向PD-1/PD-L1的抗体激活肿瘤细胞并抑制T细胞的活化,最终发生HPD
 附件下载:
附件下载: