化疗是临床上最常用的肿瘤治疗方式,但是单分子化疗药物生物利用度低,治疗副作用大,给患者身心以及其家庭带来沉重的负担。利用纳米技术将单分子化疗药物制备成纳米药物,可以实现化疗药物肿瘤靶向和可控释放,从而改善治疗效果并降低毒副作用,为实现高效低毒化疗带来曙光。
介孔二氧化硅纳米材料具有合成简单、结构可控、化学剪裁性和生物相容性好等优点,是一种具有较好临床应用前景的纳米药物载体平台。科学家们针对肿瘤微环境中微酸、乏氧、高氧化还原等特征,已发展出多种响应肿瘤微环境内源特征发生降解促发可控药物释放的智能介孔二氧化硅纳米载体。为进一步提高药物释放的可控性,目前还需开发能够响应光、声、电、磁等可区域性施加的外源刺激而降解的介孔二氧化硅纳米药物载体。
近期,苏州医工所董文飞课题组与华南理工大学邵丹研究员和美国哥伦比亚大学梁锦荣教授合作,基于前期氧化还原双重刺激响应性降解的二硒桥联介孔硅材料的工作基础(10.1002/adma.201801198),发现了这种材料能够以X射线可操控性降解的新特性。研究人员通过优化制备工艺得到粒径、孔径和硒元素含量适中的二硒桥联介孔硅,用于担载传统化疗药物阿霉素。该纳米药物具备灵敏且可控的X射线响应性降解能力,在低剂量X射线(1 Gy)的辐照下可发生快速的骨架崩解并爆发性的释放药物。
为提高纳米药物在肿瘤部位的富集能力,研究人员通过仿生策略将肿瘤细胞膜包覆在药物表面,在提高稳定性的同时,延长血液循环时间,赋予材料更好的肿瘤靶向性。在细胞和动物模型中,该仿生纳米药物实现了低剂量X射线介导的高效化疗,并显著降低了阿霉素的毒副作用。此种治疗策略还可通过诱导肿瘤细胞免疫原型死亡,使机体产生肿瘤特异性免疫反应。与免疫检查点阻断剂(anti-PD-L1)联合使用进一步促进了系统性抗肿瘤免疫反应,在抑制原发灶的肿瘤生长的同时对转移灶肿瘤也取得了较好的治疗作用。
基于二硒桥联介孔硅优异的X射线响应降解的特性,其将作为一种极具潜力的药物载体用于X射线介导的化疗、放疗和免疫联合治疗。相关研究成果已发表在国际高水平期刊先进材料(Advanced Materials, 10.1002/adma.202004385)上,并入选封面论文。第一作者为邵丹研究员、张帆和陈方满,董文飞研究员、邵丹研究员和梁锦荣教授为通讯作者。
论文标题:Biomimetic Diselenide-Bridged Mesoporous Organosilica Nanoparticle as an X-Ray-Responsive Biodegradable Carrier for Chemo-Immunotherapy.
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202004385

图1. Advanced Materials封面(未排版)
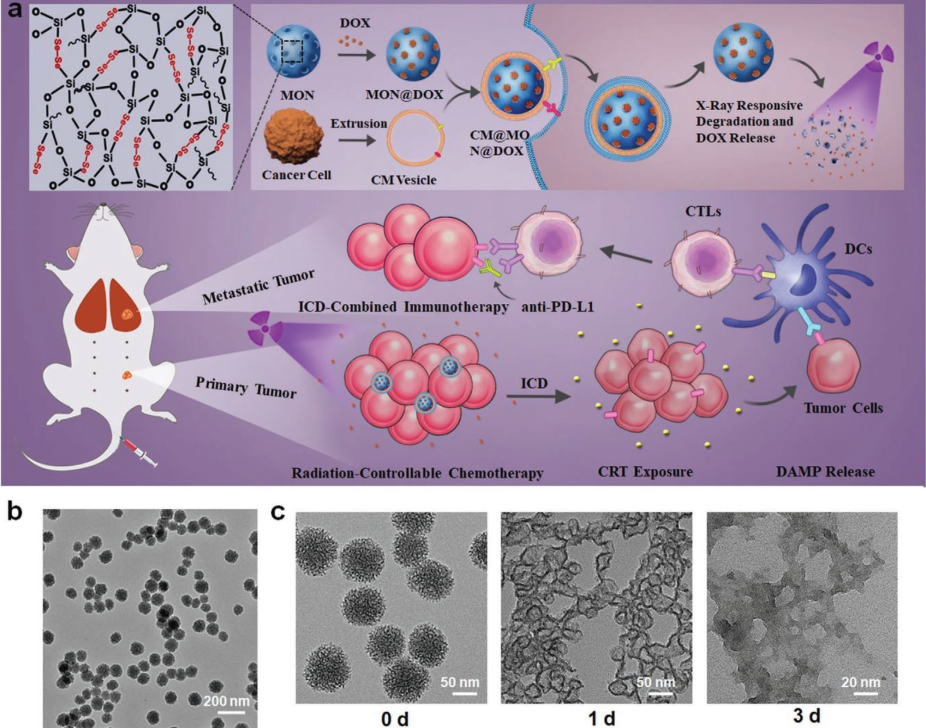
图2:二硒桥联介孔硅的制备、X射线响应降解和在化疗-免疫治疗中的应用示意图。
 附件下载:
附件下载: